2023年12月27日,先声药业旗下抗肿瘤创新药公司先声再明宣布,肿瘤化疗全系骨髓保护创新药科赛拉®(注射用盐酸曲拉西利)获中国国家药品监督管理局(NMPA)签发的药品补充申请批准通知书,同意G1 Therapeutics公司将注射用盐酸曲拉西利药品生产技术转让至海南先声药业有限公司(批准文号:国药准字H20237181)。这意味着创新药科赛拉®将在海南实现国产化,进一步提升药物对中国肿瘤患者的可及性。
化疗是多种癌症的基石疗法,但也有极高的毒副作用发生率。其中,80%的化疗药可导致骨髓抑制,引发化疗患者感染、出血、疲劳等副作用,从而造成“投鼠忌器”的困境。此前临床上应对骨髓抑制的主要干预措施是成分输血或使用细胞因子类药物。这类方法只能在骨髓损伤发生后针对单一谱系的血细胞补充数量,并不能预防全谱系骨髓抑制,可引起骨痛等副作用,长期应用还可能导致骨髓耗竭。
科赛拉®是先声药业与G1 Therapeutics合作开发的在化疗前给药、拥有全系骨髓保护作用的全球创新药,填补了此项临床空白,曾获美国FDA“突破性疗法”认定。该药物首个适应症为小细胞肺癌患者化疗前给药,以降低化疗引起的骨髓抑制发生率。先声再明拥有该产品在大中华地区所有适应症的开发与商业化权益。作为一款同类首创机制(First-in-Class)的短效、可逆性细胞周期蛋白依赖性激酶(CDK)4/6抑制剂,科赛拉®在化疗前给药,可使骨髓造血干/祖细胞暂时阻滞在细胞分裂周期的G1期,免受化疗药物的杀伤,让化疗减毒增效。
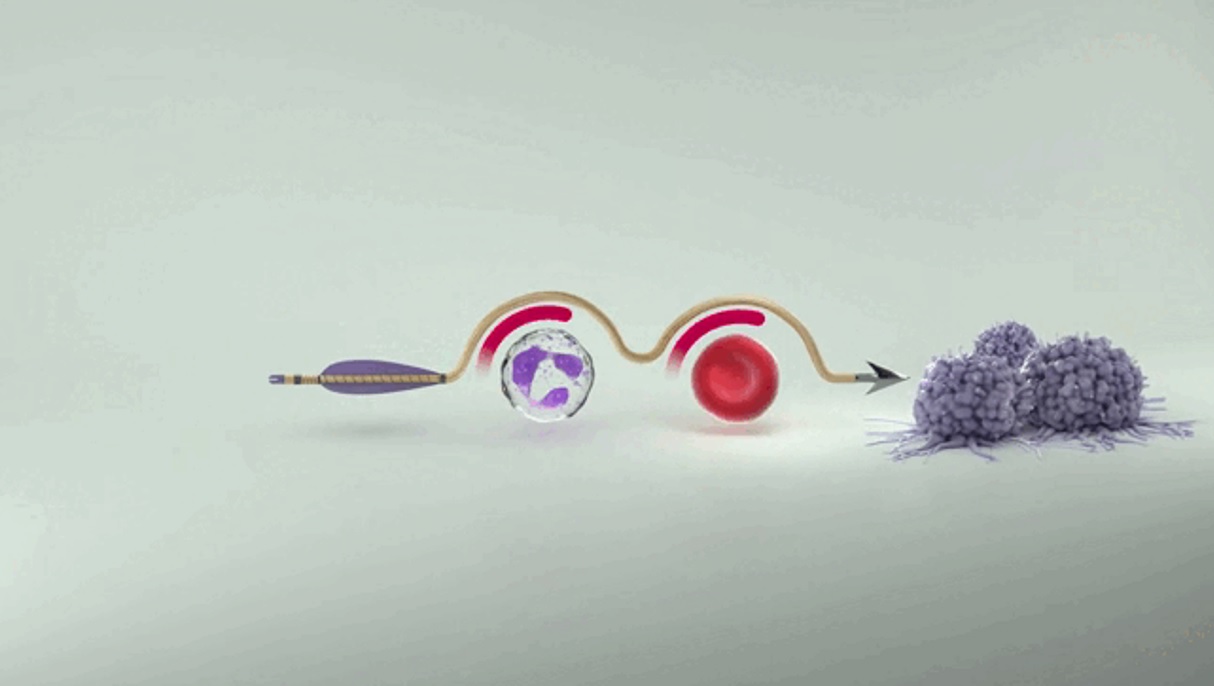
科赛拉®作用机制为化疗到来前保护骨髓造血干细胞,从根源上防止化疗导致骨髓抑制的发生
目前,科赛拉®已进入《中华医学会肺癌临床诊疗指南2023版》、《NCCN 小细胞肺癌临床实践指南》、《NCCN 造血生长因子指南》等国内外多项权威临床指南。
除小细胞肺癌外,科赛拉®正在三阴性乳腺癌、膀胱癌等瘤种开展联合化疗或ADC药物的临床研究。随着更多临床、临床前研究证据的生成,科赛拉®的骨髓保护作用有望延伸到其他瘤种,通过提高患者对化疗的耐受度,保证治疗的足量足疗程,在提高患者生活质量的同时,延长患者的生存期。
协同加速,原进口药实现国产化
为让中国患者尽早用上最新疗法,先声药业在中国数十家临床中心开展了针对小细胞肺癌的Ⅲ期注册研究(TRACES研究),该研究从获批临床试验到达到主要研究终点仅13个月。此外,科赛拉®曾作为境外已上市国内未上市的临床急需药物,利用海南博鳌乐城“国九条”政策优先落地乐城国际医疗旅游先行区,用于小细胞肺癌患者先行先试。乐城真实世界研究数据更进一步加速了科赛拉®在中国的上市注册。2022年7月12日,科赛拉®通过NMPA优先审评,在中国获得附条件批准上市,中美获批时间差仅17个月,速度远超同时期其他进口品种。

为进一步保障该药物对中国患者的可及性,先声再明在科赛拉®上市一年内进一步完善了药物安全性与疗效数据,并在海南省药监局的指导下积极开展原研地产化的各项工作。2023年10月 ,科赛拉®首个适应症通过国家药品监督管理局(NMPA)审评审批,从附条件批准转为常规批准。2023年12月,NMPA通过审评,认定先声药业位于海口高新区的生产线及相关技术条件符合要求,批准海南先声药业有限公司成为注射用曲拉西利地产化品种的上市许可持有人,生产场地为位于海南省海口市高新技术开发区的海南先声厂区。
本次科赛拉®地产化获批,也是在海南自贸港及乐城有关引进创新药械政策支持下,首次实现“乐城研用+海口生产”前区后厂模式的创新实践。地产化的获批也为科赛拉®新增规格提供了条件。目前,先声再明已启动科赛拉®新规格的研究工作,计划在原有300mg规格基础上新增100mg规格,更进一步方便医生和患者的临床用药选择。